بر خلاف تصور رایج، کاربرد مهندسی بافت تنها محدود به ترمیم یا جایگزینی بافت های آسیب دیده در بدن نمیشود، بلکه موارد دیگری چون مدل های مطالعاتی و آموزشی، شناسایی داروها و حتی تولید مواد غذایی را نیز شامل میشود. به عنوان مثال، روند تشکیل یک بافت مهندسی شده میتواند حاوی اطلاعات بسیار مهمی در رابطه با عوامل متعدد مؤثر بر تشکیل بافت در بدن بوده و دانش زیست شناسی تکوینی را توسعه بخشد. همچنین بافتهای مهندسی شده میتوانند مدلهای آزمایشگاهی مناسبی جهت مطالعه بیماریهای مختلف و شناخت عوامل بیماریزا باشند و حتی میتوانند به گونه ای طراحی شوند که مناسب برای آموزش دانشجویان پزشکی باشند. به عنوان مثال، امروزه آموزش جراحی قبل از ورود به اتاق عمل روی جسد انسان انجام میشود، اما در مواردی چون جدا کردن تومور سرطانی از بافت آسیب دیده، شرایط جسد با واقعیت بسیار متفاوت است و این در حالی است که میتوان بافتهای مهندسی شده را به گونه ای ساخت که شامل تومور یا نقصی خاص باشند. بر این اساس، مهندسی بافت میتواند علاوه بر رویکرد درمانی، رویکرد آموزشی - پژوهشی نیز داشته باشد.
آشنایی با مفاهیم پایه در مهندسی بافت
کاربرد مهندسی بافت
در صنعت داروسازی، داروهای جدید بایستی قبل از تجویز برای انسان، توسط مدلهای آزمایشگاهی مناسب مورد ارزیابی قرار گیرند. استفاده از مدل های حیوانی، به عنوان تنها راهکار موجود برای مطالعه اثر داروها، با چالشهایی چون مسائل اخلاقی، زمان طولانی، هزینه بالا و پیش بینی ضعیفِ ناشی از تفاوتهای حیوان و انسان همراه است. بنابراین کاربرد دیگر مهندسی بافت میتواند ساخت مدلهای آزمایشگاهی جهت بررسی کارایی و اثرات داروهای جدید باشد که اصطلاحاً «غربالگری دارو»1 نامیده میشود.به عنوان مثال، یک کبدد مهندسی شده متشکل از هپاتوسیتهای عملکردی میتواند جهت مطالعه متابولیسم داروهای مختلف،، جایگزین مدلهای چالش برانگیز حیوانی شود. بر اساس این ایده، تاکنون اندام های مختلف انسان از قبیل شش، روده، طحال، کبد، کلیه، عروق و قلب روی قطعات کوچک چند سانتی متری به شکل تراشههای الکترونیکی شبیه سازی شده اند (شکل 1). این مدلها که تحت عنوان «اندام روی تراشه»2شناخته می شوند، قادر به انجام چند وظیفه شاخص از اندام مورد نظر بوده و با ورود مواد از طریق راهگاههای میکرو مقیاسس به درون خود، خروجیهایی که قابل آنالیز توسط رایانه باشند ارائه میدهند.

شکل 1) نمونه هایی از اندام روی تراشه که تاکنون توسعه یافته اند.
با توجه به آن که از محدودیتهای این تراشه ها، بررسی مستقل یک اندام، بدون در نظر گرفتن اثرات متقابل آن با دیگر اندام های بدن است، اخیراً (سال 2012) پروژه ای با حمایت مالی وزارت دفاع امریکا کلید خورده است که هدف آن گنجاندن ده اندام، از اندام های مهمِ تأثیرپذیر از موادورودی به بدن، روی یک تراشه کوچک است به طوری که با یکدیگر در ارتباط باشند و مدلی از «کل بدن روی یک تراشه»3 را تشکیل دهند (شکل 2). چنین تراشه ای، می تواند در مدت زمانی کوتاه، اطلاعات دقیقی از اثراتت احتمالی مواد ناشناخته روی قسمت های مختلف بدن ارائه دهد و لذا ابزاری مناسب جهت تست داروها در صنعت داروسازی و یا شناسایی مواد مشکوک در میدان های جنگ به شمار میرود.
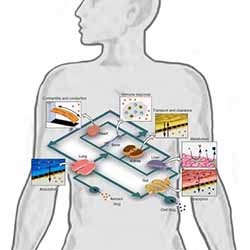
شکل 2) شمایی از ایده کل بدن روی یک تراشه؛ مجموعه ای از ده اندام مرتبط با هم.
کاربرد دیگری که میتوان برای مهندسی بافت متصور شد، تولید گوشتهای مهندسی شده سالم و تازه، مشابه با گوشتهای خوراکی رایج است. بر اساس این ایده، در آگوست 2013 در یک برنامه تلویزیونی از یک ظرف گوشت مهندسی شده پرده برداری شد که ادعا میشد شباهت زیادی به گوشت گاو داشته و مصرف آن برای انسان کاملاً بی خطر است؛ ادعایی عجیب که هرگز ثابت نشده و بسیار قابل تردید است (شکل 3). گذشته از خطراتی که مصرف این گوشت برای انسان میتواند داشته باشد، هزینه تولید یک ظرف کوچک از آن چنان بالاست، که به نظر می رسد موفقیت چنین ایدهای غیرممکن باشد. به هر حال، ممکن است با پیشرفت بیشتر تکنولوژیهای کشت سلول، روزی گوشت های مهندسی شده جایگزین گوشت های حاصل از ذبح دام شوند.

شکل 3) گوشت مهندسی شده ای که با هزینه 332000 دلار (حدود 100.000 برابر یک گوشت طبیعی) تولید شده است.
واژه سلول بنیادی، نخستین بار در سال 1960 توسط یک بافت شناس روسی به نام الکساندر ماکسیموف4مطرح شد. منشأ این نامگذاری، مشاهده باز تولید سلولهای خونی در بدن انسان توسط دسته دیگری ازز سلولها بود و از آنجا که برخی سلولها به عنوان منشأ دیگر سلولهای بدن پنداشته شدند، سلولهای اصلی، سلول بنیادی یا سلول ساقهای نامیده شدند. سلولهای بنیادی با دو ویژگی اساسی قابلیت خود نوزایی5 و تمایز6شناخته میشوند. این دو ویژگی را اصطلاحاً بنیادینگی7 می نامند. در خود نوزایی سلول بنیادی در طی تقسیم سلولی، سلول مانند خود را تولید میکند و در تمایز، سلول بنیادی یک سلول با گونه متفاوت راا می سازد. سلول تمایز یافته پروتئین های متفاوتی دارد و در نتیجه عملکرد متفاوتی خواهد داشت.
همان طور که در شکل زیر نشان داده شده است، سلولهاي بنيادي را ميتوان به سه گروه اصلي شامل سلولهاي بنيادي بزرگسال8،سلولهاي بنيادي جنيني9 (ES) و سلولهاي بنيادي پرتوان القائي10 (iPS) تقسيم كرد.
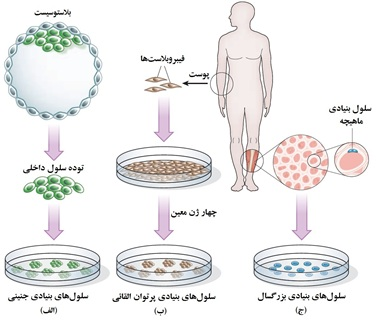
شکل 4) انواع اصلی سلولهای بنیادی و نحوه تهیه آنها: (الف) سلولهای بنیادی جنینی، (ب) سلولهای بنیادی پرتوان القائی و (ج) سلولهای بنیادی بزرگسال.
سلول هاي بنيادي بزرگسال، سلول هایی هستند که در اندامهای مختلف بزرگسالان وجود دارند و وظیفه آنها ترمیم و بازسازی بدن است. این سلولها دارای قابلیت تکثیر و خودنوزایی محدود هستند و به همین دلیل تومورزا نیستند. همچنین قابلیت تمایز به همه انواع سلولهای بدن را ندارند و فقط میتوانند به سلولهای مربوط به بافت خود تبدیل شوند و اصطلاحاً چندتوان11هستند. از جمله سلولهاي بنيادي بزرگسال میتوان به سلول هاي بنيادي خون ساز12اشاره کرد كه در مغز استخوان يا بند ناف يافت مي شوند و مي توانند به همه انواعع سلولهاي خوني تبديل شوند و همچنين سلولهاي بنيادي مزانشيم (13 (MSC كه آنها نيز عمدتاً از مغز استخوان استخراج شده و ميتوانند به سلولهای سازنده بافتهایی چون استخوان، غضروف، ماهیچه و چربی تمايز يابند.
سلول های بنیادی جنینی، از توده سلولي داخلي14 کرهای که در مرحله بلاستوسيست15 از تکوین جنین (روز پنجم تا هفتم) ایجاد میشود به دست میآیند. سلولهای ES پرتوان16 هستند، یعنی ميتوانند به سلول های هر سه لايه جنيني اكتودرم، مزودرم و اندودرم تمايز يابند و به اين ترتيب ميتوانند به همه انواعع سلولهاي اختصاصي بدن تبديل شوند. همچنین این سلولها قابلیت تکثیر نامحدود در محیط آزمایشگاه را دارند. این ویژگی باعث توانایی تشکیل تومور در این سلولها شده است.
سلول هاي بنيادي پرتوان القائي، سلولهاي بالغ (مانند فیبروبلاست) هستند كه از طریق دستکاری ژنتیکی توسط چند فاکتور معین، به سلولهاي بنيادي شبه جنيني بازبرنامه ريزي17 شده اند. سلولهای iPS نخستین بار از سلول های فیبروبلاست موش و انسان،به ترتیب در سالهای 2006 و 2007 تولید شدند. این سلول ها از نظر كيفي با سلول های بنیادی جنینی برابري ميكنند، به طوری که قابلیت تکثیر نامحدود دارند و می توانند هر سه لایه جنینی و در نتیجه تمامی انواع سلولهای بدن را تولید کنند.
سلول های بنیادی جنینی و پرتوان القایی را بطور کلی سلول های بنیادی پرتوان می گویند.
1Drug screening
2Organ-on-chip
3Body-on-a-chip
4Alexander Maksimov
5Self renewal
6Differentiation
7Stemness
8Adult stem cell
9Embryonic stem cell
10Induced pluripotent stem cells
11Multipotent
12Hemapoietic stem cell
13Mesenchymal stem cells
14Inner cell mass
15Blastocyst
16Pluripotent
17Reprogra
نویسنده: محمد حسین قانیان- دانشجوی دکتری مهندسی پلیمر
نظر دادن
