دارورسانی شخصی سازی شده (personalized medicine) طبق تعریفی که در سال 2016 از آن ارائه شد، عبارت است از: "شیوه ای برای انتقال دارو به فرد به گونه ای امن و مؤثر و متمایز از سیستم های دارورسانی جمع گرا (mass-oriented delivery systems)."
دارورسانی شخصی سازی شده و تکنولوژی چاپ سه بعدی
هسته اصلی این مفهوم، در نظر گرفتن تفاوت های فردی بین بیماران در هر دو فرایند تشخیص بیماری و تعیین نوع و دوز مناسب دارو است، که این امر در افزایش میزان بازدهی دارو و نیز افزایش پذیرش و سازگاری بیمار با داروی تجویز شده بسیار مؤثر است.
شکل1: نیازها برای دارورسانی شخصی سازی شده [1].
در این راستا، در علوم پایه و ژنتیک پیشرفت های بسیاری تا به امروز صورت گرفته است؛ از جمله پی بردن به نقش تفاوت های ژنتیکی در ابتلای افراد به بیماری، استفاده از اطلاعات ژنتیکی بیمار در پیش بینی چگونگی پاسخ او به یک داروی مشخص و نیز ساخت داروهای بیولوژیکی و نوترکیب جدید. با وجود پتانسیل بالای بسیاری از این تکنولوژی ها برای متحول ساختن نظام دارو درمانی، ورود بسیاری از آن ها به این عرصه، منوط به توسعه و پیشرفت روش های نوین در طراحی و ساخت سیستم های دارورسانی، به شیوه ای هوشمند و با قابلیت شخصی سازی، می باشد.
اخیراً تکنولوژی چاپ سه بعدی به دلیل انعطاف پذیری بالا نسبت به روش های مرسوم در صنعت داروسازی و نیز قابلیت ساخت سیستم هایی با هندسه و ساختار پیچیده، به عنوان راهکاری برای حل این چالش و عملیاتی ساختن دیدگاه دارورسانی شخصی سازی شده توجه زیادی را به خود جلب کرده است. به ویژه پس از سال 2015 و با پذیرش اولین داروی ساخته شده بر اساس این تکنولوژی توسط FDA، امیدها برای حضور پررنگ تر این تکنولوژی در حوزه دارورسانی به شدت افزایش یافته است [2].
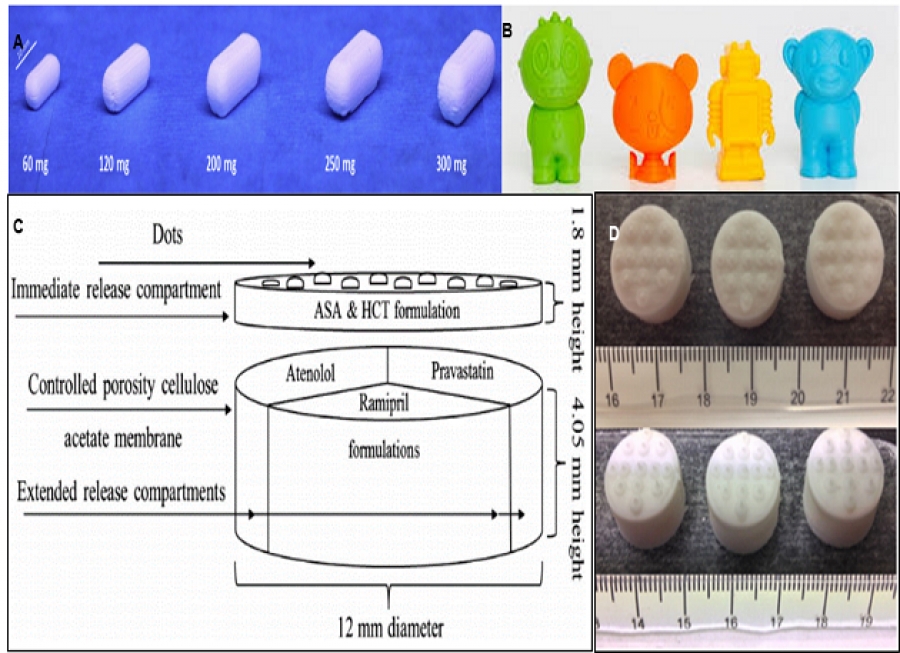
انعطاف پذیری بالای این روش قابلیت های زیادی را در حوزه دارورسانی شخصی سازی شده فراهم می آورد. از جمله، امکان ساخت داروهایی با دوزهای مختلف از عنصر درمانی براساس تفاوت های سنی، جنسیتی، توان متابولیکی و غیره، ساخت پلی پیل هایی (polypill) برای قرار دادن تمامی داروهای مصرفی یک شخص در طول روز در یک قرص، طراحی و ساخت ایمپلنت های حاوی دارو با سازگاری بالا با آناتومی بیمار و یا حتی ساخت داروهایی با شکل های جذاب برای افزایش پذیرش دارو در کودکان.
شکل 2: نمونه هایی از داروهای ساخته شده با تکنولوژی چاپ سه بعدی. A) قرص تئوفیلین در دوزهای مختلف [3].
B) داروهایی با شکل های مختلف برای کودکان [4]. C) یک پلی پیل حاوی پنج دارو با پروفایل رهایش مختلف [5].
چالش دیگری در زمینه دارورسانی که چاپ سه بعدی می تواند در آن مؤثر واقع شود دستیابی به پروفایل رهایش مطلوب برای عنصر درمانی مورد نظر است. ورود پلیمرها به صنعت داروسازی در اوایل قرن بیستم با هدف ساخت سیستم هایی با نرخ رهایش و نیز زمان عملکرد قابل کنترل در بدن بیمار، یکی از تحولات بزرگ این عرصه به شمار می رود. اضافه شدن تکنولوژی چاپ سه بعدی به این عرصه در قرن بیست و یکم می تواند زمینه ساز تحول بزرگی دیگر در آن باشد. این تکنولوژی امکان کنترل دقیق تر بر نحوه رهایش دارو را با استفاده از قابلیت ساخت آرایش های مختلف از دارو و پلیمر فراهم می آورد. طراحی و ساخت سیستم هایی با پروفایل رهایش خطی از طریق ثابت نگه داشتن سطح رهایش دارو، سیستم هایی با تخلخل بالا برای هضم و جذب آسان تر عنصر درمانی و یا سیستم هایی حاوی چند دارو با پروفایل های رهایش مختلف برای هر یک از آن ها از جمله این موارد هستند.
در این راستا گروهی از محققان در دانشگاه MIT با استفاده از روشی نوین در تکنولوژی چاپ سه بعدی و با بهره گیری از کوپلیمرهای اصلاح شده PLGA با نرخ تخریب قابل کنترل، سیستمی را برای تزریق یکباره چندین واکسن ساخته و مورد بررسی قرار دادند. در این سیستم، عنصر درمانی که همان واکسن مورد نظر است در مرکز میکروذراتی با ابعاد 400 میکرومتر قرار گرفته و پس از تخریب کامل پوشش پلیمری، کل دارو به صورت آنی آزاد می شود؛ زمان این رهایش آنی به ساختار پلیمر بستگی دارد، با این حال ساختار منحصر به فرد آن است که از نشت دارو تا زمان مقرر جلوگیری می کند. این سیستم دارورسانی این امکان را فراهم میکند که چندین واکسن با زمان تزریق مشخص به یکباره به بیمار تزریق شود و از عوارض و دردهای پس از هر تزریق جلوگیری به عمل آید. در تست های حیوانی انجام شده در این تحقیق به اثبات رسیده است که عملکرد این سیستم از نظر غلظت مناسب دارو در جریان خون، و نیز عملکرد بیولوژیکی مورد انتظار واکسن های استفاده شده، با تزریق مجزای واکسن ها در مقاطع زمانی مشخص برابری می کند.
شکل 3:A) شماتیک فرایند ساخت میکروذرات PLGA حاوی آنتی ژن با استفاده از قالب های PDMS روی سطح تفلون. B) شماتیک سرنگ حاوی میکروذرات با رهایش آنی آنتی ژن های
مختلف در مقاطع زمانی مشخص. C) پروفایل رهایش برون تنی (بالا) و درون تنی (پایین) دکستران کپسوله شده داخل سه میکروذره از جنس PLGA با گروه های عاملی مختلف.
در انتها باید گفت با وجود پتانسیل بالای تکنولوژی چاپ سه بعدی برای به کارگیری در دارورسانی، در حال حاضر چالش هایی بر سر راه آن وجود دارد. از جمله زمان بر بودن فرایند، هزینه بالای دستگاه ها، محدودیت مواد قابل استفاده و نیز چالش های افزایش ظرفیت تولید.
مراجع:
[1] A new chapter in pharmaceutical manufacturing: 3D-printed drug products
[3] A flexible-dose dispenser for immediate and extended release 3D printed tablets
[4] ?3D-Printed Drugs for Children—Are We Ready Yet
[6] Fabrication of fillable microparticles and other complex 3D microstructures
نویسنده: مریم اسدی کورایم- دانشجوی کارشناسی ارشد مهندسی پزشکی